超声介导下对正常犬行肝脏活组织检查
超声介导活组织检查分为细针抽吸活组织检查(FNA)及组织芯活组织检查(TCB)。国外兽医已经将其作为临床常规诊断方法。近年来,国内兽医应用超声介导FNA越发普及[1],但TCB应用较少,且国内关于两种活组织检查方法安全性、术后恢复情况评估的研究依然不足。本文通过对正常犬肝脏组织及局部坏死灶模型进行超声介导活组织检查,分别评价此操作的安全性、准确性以及TCB术后恢复情况。
1 材料与方法
1.1 试验动物
选用小型成年杂种试验犬12只,体重5-7kg(5.56±0.72kg),雌性犬4只,雄性犬8只。试验犬笼养并饲喂商品犬粮,期间饮用清洁自来水,精神状态、饮食欲良好,排便排尿正常。体格检查血常规和生化检查均表现正常。饲养至少1周后进行试验。
1.2 试验药品与仪器
陆眠宁Ⅱ注射液,吉林省华牧动物保健品有限公司;舒泰50注射液(5ml:0.03g),法国维克制药公司;乙酸(冰醋酸,分析纯),北京化工厂;0.9%氯化钠注射液(100ml:0.9g),石家庄四药有限公司;一次性使用无菌注射器(5ml),上海双鸽实业有限公司;14G×9cm半自动活检针,普利赛医疗器械公司;Mylab30Vet便携式超声仪,意大利esaote公司;医用数字X线机,西班牙sedecal公司;ProcyteDx全自动血细胞分析仪、Catalyst Dx生化分析仪,美国爱德士缅因生物科技公司。
1.3 试验方法
本试验选用12只小型成年杂种试验犬,随机选取6只试验犬作为造模活组织检查组(第1组,雌性犬2只、雄性犬4只。用于准确性研究);6只试验犬作为非造模活组织检查组(第2组,雌性犬2只、雄性犬4只。用于安全性研究)。
1.3.1 术前检查
对试验犬进行全面体检,X线及超声检查重点评价腹腔脏器及腹膜腔形态,血液常规检查重点评价红细胞数量(RBC)、血红蛋白浓度(HGB)、红细胞比积(HCT),血液生化检查重点评价丙氨酸氨基转移酶(ALT)及天冬氨酸氨基转移酶(AST),凝血功能检查重点评价血小板计数(PLT)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)。
1.3.2 肝脏局部坏死灶模型制作
生物安全柜内量取70ml分析纯乙酸,以0.9%氯化钠注射液定容至100ml制备70%乙酸-氯化钠溶液。
全身麻醉后超声介导下向第1组试验犬左肝外叶腹侧、背侧及右肝外叶腹侧、背侧(共4个位点)局部注射70%乙酸-氯化钠溶液(0.05ml/次)制作肝脏局部坏死灶模型。
1.3.3 FNA
全身麻醉后超声介导下对第1组试验犬肝脏局部坏死灶模型及第2组试验犬肝脏相同部位进行FNA,每只试验犬均有4个活检位点,理论活检次数为48次。术后即刻进行超声检查;术后5小时进行超声、血液常规检查;术后24、48、72小时进行超声、血液常规、血液生化检查。将活检所得样本进行细胞学检查。
1.3.4 TCB
两组试验犬于FNA术后1周进行肝脏TCB。全身麻醉后超声介导下对第1组试验犬肝脏局部坏死灶模型及第2组试验犬肝脏相同部位进行TCB,每只试验犬均有4个活检位点,每组试验犬理论活检次数为24次。术后定期对试验犬进行影像学、血液学检查。将活检所得样本进行组织学检查。
1.3.5 剖检
于术后第2、4、6周随机选择两组试验犬各1只(共6只)实施安乐并进行剖检,于术后第8周将剩余两组试验犬各3只(共6只)实施安乐并进行剖检。取肝脏活检部位及正常肝脏组织样本进行组织学检查。
2 试验结果
2.1 术前检查
两组试验犬术前腹部右侧位X线影像中,肝脏表现为胃头侧的液体或软组织密度影像。通过胃内的气体影像可主观辨别肝脏后界并估算肝脏体积。X线片中可见肝脏腹侧肝叶的边界锐利,大致位于肋弓之内,表明肝脏未见明显增大。根据胃的影像位于正常位置可以反推肝脏未见明显占位性团块(图2.1)。
两组试验犬术前腹部超声声像图中,肝脏实质回声质地粗糙,肝尖锐利。胆囊呈无回声至产回声的囊性结构,伴后方回声增强。门静脉表现为外围高回声,内部无回声的管状结构。肝静脉表现为无回声管状结构。由门静脉、肝静脉、肝内胆管组成的脉管纹理清晰可辨。(图2.2)
两组试验犬术前血液学检查结果全部位于参考范围之内。RBC、HGB、HCT位于参考范围之内,无明显贫血迹象;PLT大于180×109/L,PT小于9.1s,APTT小于18s,无明显凝血不良迹象;ALT、AST位于参考范围之内,无明显肝脏功能异常迹象。

图2.1 试验犬术前腹部右侧位X线检查影像
影像中可见肝脏体积始终未超过最后肋弓,肝尖锐利;腹腔浆膜细节良好;脾脏、肾脏、胃肠道形态未见明显异常。
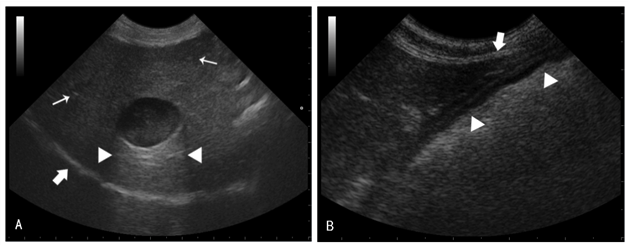
图2.2 试验犬术前腹部超声检查声像图
A:正常肝脏实质回声质地粗糙,可见强回声的门静脉壁(细箭号),胆囊呈无回声至产回声的囊性结构伴后方回声增强(三角之间),远场可见强回声的膈界面(粗箭号);B:正常肝脏肝尖锐利(粗箭号),尾背侧与胃相接(三角)。
2.2 肝脏局部坏死灶模型
为避免乙酸-氯化钠溶液沿针道溢出所致坏死灶形状不规则及刺激周围软组织形成无菌性腹膜炎,本试验选择1ml注射器(4.5号针头,26G)进行造模。
超声介导下,当注射器针尖的影像进入预定位置时,将乙酸溶液快速注入。等待5秒后再按原路径出针,以防凝固未完全致多余乙酸溶液沿针道渗出。于注射后即刻对相应部位进行超声检查(图2.3)。注射部位回声显著增强、有时局部伴有不洁声影、与周围正常组织界限清晰可辨。造模24小时后再次对局部坏死灶进行超声检查,可见局部坏死灶呈椭圆形至不规则边界清晰的强回声区,大小较为固定(直径0.51±0.03cm)。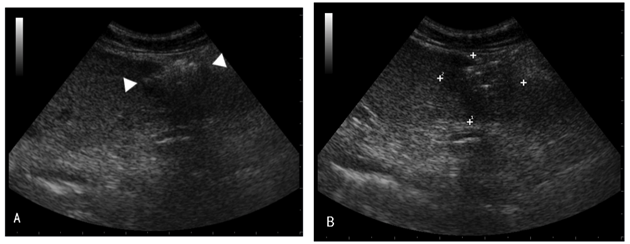
图2.3 肝脏局部坏死灶模型超声声像图
A:造模即刻局部坏死灶超声声像图(三角之间);B:造模24小时局部坏死灶超声声像图(光标之间)。
2.3 FNA
2.3.1 FNA准确性
本试验以肝脏局部坏死灶作为靶位点,以第1组评价活组织检查准确性。为保证穿刺成功,靶位点应始终位于超声声像图之内,且穿刺针的整个针体应全程可见(图2.4)。当穿刺针针尖(针体末端的强回声光点)出现在靶位点附近时,方可沿着穿刺路径进行反复穿刺。值得注意的是,反复穿刺使大量血液进入针体内,稀释样本的同时加大了凝血的风险,不利于细胞学检查。因此,采样合格率亦为评价FNA成功与否的一个方面。
本研究中造模组试验犬共6只,肝脏局部坏死灶模型共24个。FNA活检共27次,其中穿刺失败3次(1次穿刺失准,2次样本不合格)。本研究中肝脏FNA准确率为24/27(88%)。
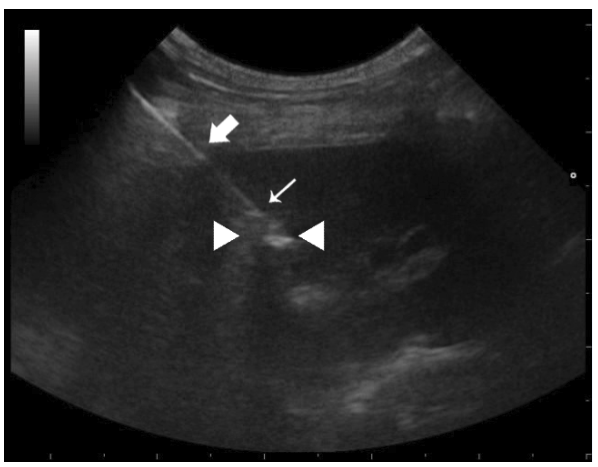
图2.4肝脏局部坏死灶FNA
超声声像图中全程可见穿刺针针体(粗箭号)、针尖(细箭号),坏死灶(三角之间)
本试验将两组试验犬肝脏FNA所得样本进行细胞学检查(图2.5)。
第1组由于穿刺部位为局部坏死灶,因此细胞学涂片中除了外周血为背景之外,还可见大量红染的渗出或细胞坏死崩解后产物。细胞成分包括正常的肝细胞及坏死细胞:背景大面积红染,红细胞破碎、大小不等、边缘模糊不清,大量嗜中性粒细胞及吞噬细胞;肝脏异常的肝细胞肿胀甚至破碎、边缘模糊不清、胞浆不均匀呈云絮状。
第2组穿刺部位为健康肝脏,因此细胞学涂片中细胞形态、结构正常:背景可见外周血,形态规则、边缘清晰、着色良好;肝脏正常肝细胞呈大而圆至多边形、边缘清晰、胞核居中、胞浆丰富呈均匀分布的蓝染颗粒状。
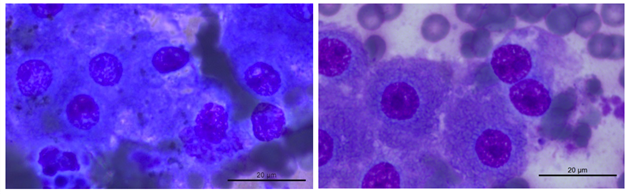
图2.5造模组FNA细胞学涂片(左)与正常肝脏细胞学涂片(右)对比
前者可见背景红染,细胞肿胀、结构无法分辨,亦可见细胞破碎,染色多样;后者可见形态规则的肝细胞,胞浆呈均匀颗粒样,染色良好。
2.3.2 FNA安全性
穿刺过程中及穿刺完毕出针后即刻对穿刺部位进行超声检查以监测积液、出血等活组织检查并发症。实时超声检查可见少量空气沿针道进入腹腔,出现“振铃伪影”。于FNA术后即刻、5小时、24小时、48小时、72小时进行超声检查,评价第2组试验犬肝脏及腹膜腔情况。其中部分犬肝脏周围出现无回声暗区,且无回声暗区基本于穿刺后72小时之内逐渐减小直至消失(如图2.6)。对比术前术后测量数据差异不显著,肝脏形态无明显改变。于FNA术后5小时、24小时、48小时、72小时进行血液常规检查。术后5小时检查试验犬HCT与术前检查所得数据进行对比,部分犬术后HCT较术前有所下降,但仍处于正常范围内;下降幅度均未达到术前检查数据的10%,结合超声检查结果得出未见严重出血的结论,无需进行手术或药物干预。
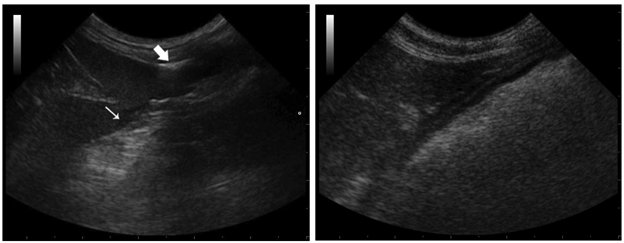
图2.6肝脏FNA术后即刻(左)及术后72小时(右)实时扫查
可见部分犬肝尖周围少量无回声暗区(细箭号),针道路径上腹膜腔可见气体形成的“振铃伪影”(粗箭号);上述异常征象均于术后72小时消失。
2.4 TCB
2.4.1 TCB准确性
与FNA相同,活检靶位点应始终位于超声声像图之内,且活检针的整个针体应全程可见(如图2.7)。当活检针针尖(针体末端的强回声光点)进入活检量程时,方可沿着活检路径推出内针。当采样槽内充满靶位组织与周围正常组织时,推动扳机使切割套针向下移动从而将组织留在采样槽内。
本研究中造模组试验犬共6只,肝脏局部坏死灶模型共24个。TCB活检共31次,其中穿刺失败7次(3次穿刺失准,4次样本不合格)。本研究中肝脏TCB准确率为24/31(77%)。
造模组TCB所得样本组织学检查显示,活检所得样本中存在坏死组织细胞(如图2.8),说明活检针可准确到达靶位并成功采样。
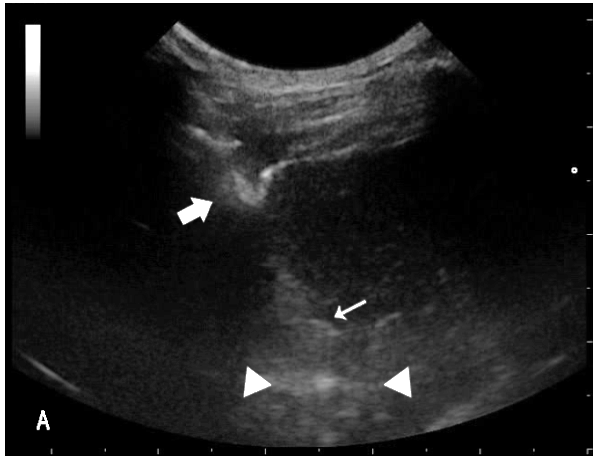
图2.7肝脏局部坏死灶TCB
全程可见切割套针(粗箭头)、内针(细箭头)、坏死灶(三角之间)。坏死灶均位于穿刺针的穿刺路径之上。
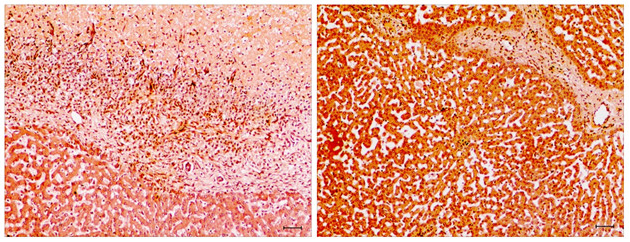
图2.8造模组TCB组织学切片(左)与正常肝脏组织学切片(右)对比
前者可见坏死细胞及正常肝细胞,中间为大量白细胞浸润;后者可见基本单位肝小叶,小叶间静脉、门静脉、小叶间结缔组织结构清晰,肝细胞形态规则、边缘清晰、着色良好。
2.4.2 TCB安全性
穿刺过程中及出针后即刻对穿刺部位进行超声扫查以监测积液、出血等活组织检查并发症。与FNA相似,实时超声检查可见少量空气沿针道进入腹腔,出现超声声像图中的“振铃伪影”。
于TCB术后即刻、5小时、24小时、48小时、72小时进行超声检查,评价试验犬肝脏及腹膜腔情况。与FNA结果相似,其中部分试验犬穿刺部位于术后出现无回声暗区,且无回声暗区基本于术后72小时之内逐渐减小直至消失。术后5小时试验犬HCT与术前检查所得数据进行对比,部分犬术后HCT较术前有所下降,但仍处于正常范围内;下降幅度均未达到术前检查数据的10%,结合超声检查结果得出未见严重出血的结论,无需进行手术或药物干预。
2.5 活检术后恢复情况
造模组犬肝脏受坏死灶影响,难以评价TCB活检部位恢复情况。故于TCB术后2、4、6、8周对非造模组犬实施安乐并进行尸体剖检。剖检结果表明,时间越长,犬肝脏TCB所致损伤恢复情况越好。肝脏TCB活检部位未见结缔组织粘连,针孔处随时间变化逐渐平滑,肉眼观察颜色逐渐与周围肝组织一致。
取TCB活检部位肝脏组织进行组织学检查。总体来讲恢复时间越长,针道直径越小、修复情况越好(如图2.9)。遗憾的是,于第8周剖检所得样本中结缔组织均未完全充满整个针道、红细胞溶解的情况依旧持续存在。根据结缔组织、新生血管、组织细胞及红细胞溶解的程度可得出损伤未完全修复的结论。
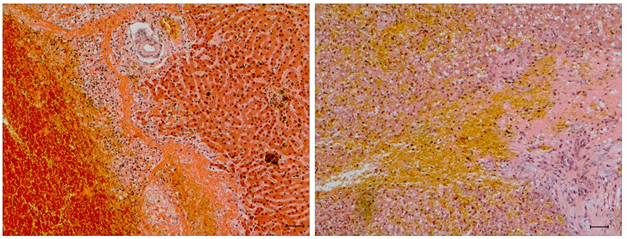
图2.9 2只犬肝脏TCB术后2周(左)及8周(右)活检部位组织学切片
术后2周可见针道被大量红细胞填充,红细胞破碎、溶解,针道附近可见大量含铁血黄素。术后8周剖检结果可见针道面积减小,红细胞形态基本不可分辨,可见大量含铁血黄素,周围可见红染结缔组织。
3 分析与讨论
3.1 超声介导肝脏活检准确性
比较本试验肝脏FNA、TCB穿刺准确率可知:
(1)FNA穿刺准确率高于TCB。FNA穿刺针(18-22G)直径小,穿刺时无需用力即可轻易穿透皮肤、腹壁及靶器官包膜,且对固定靶器官要求较低[2]。TCB活检针(14-18G)直径大,即使预先做皮肤切口,在穿透腹壁、靶器官包膜时亦需要用力较大,否则靶器官容易移位。因此TCB对辅助固定靶器官要求较高[3]。就笔者经验来讲,FNA时超声探头用力下压皮肤,使靶器官紧贴皮肤的同时进行辅助固定;而TCB时建议按照皮肤、腹壁、靶器官的顺序依次穿透,此方法可随时对穿刺路径进行微调,避免一次用力穿透多层组织导致靶器官移位[4]。
Hager等人得出肝脏采样准确率为80-90.5%[5],而本试验超声介导活检采样准确率分别为88%、77%。原因分析如下:本试验选用小型犬作为试验对象;本试验肝脏局部坏死灶模型直径小(约为0.05cm);本试验将镜检可见坏死灶组织、细胞[6-7]视为采样合格,并将采样合格率计入准确率。
(2)穿刺坏死灶难度大。本试验中肝脏局部坏死灶模型直径较小,活检难度较大。为避免穿刺失准,首先应全面地对靶器官进行超声扫查,选定穿刺路径最短、组织结构最为简单的位置作为探头扫查位点。其次,对于脾脏、肾脏等游离性较大的靶器官,应有操作人员在两侧辅助固定。最后,可按照皮肤、腹壁、靶器官的顺序依次穿刺,微调穿刺路径。
3.2 超声介导肝脏活检安全性
Watson等人认为发生血小板减少症(血小板计数小于120×109/L)或凝血障碍(活化部分凝血活酶时间APTT大于18秒,凝血酶原时间PT大于9.1秒)时为活检禁忌症,应谨慎进行风险评估[8]。本试验中试验犬均体况良好、术前检查未见明显异常,故试验中未出现严重并发症,无需手术干预或用药治疗。Christensen等人指出也可在术前12小时使用维生素K进行保护性用药[9]。
超声检查表明在试验条件下,活组织检查并发症少且程度轻微。实时超声扫查中可见穿刺部位出现无回声暗区,根据靶器官的性质判断应为少量出血或积液。该情况仅出现在活组织检查完毕即刻及术后5小时,一般于术后24小时便无法探查。推断其原因有两点:一是出血或积液量很少,散布在腹膜腔中迅速吸收;二是出血后形成散在的血凝块,其超声征象不易与周围软组织区分。无论是FNA还是TCB,出针后应立即用无菌纱布或止血明胶[10]压迫穿刺部位,压迫时间应根据靶器官、进针位点皮肤组织情况适当调整。TCB术后压迫时间可较长,待未见出血后再进行超声检查。偶见由于超声探头按压过力或反复穿刺导致的皮下淤血与水肿,一段时间内均可自行消退。
术后血液学检查结果表明FNA、TCB对靶器官功能影响差异不显著。
3.3 肝脏活检术后组织恢复情况
本试验中,超声介导活组织检查术后即刻至5小时出现的超声征象有穿刺部位靶器官局部无回声暗区、穿刺位点进入空气形成“振铃伪影”、靶器官周围软组织局部回声增强。所有超声征象均在术后24小时消失,之后的超声检查未见明显异常[11]。试验记录的穿刺部位形态均未有明显改变。血液常规、血液生化检查指标(如HCT、ALT、AST等)均在正常范围之内,变化差异不显著。说明在本试验条件下,超声介导活组织检查对靶器官大体形态及功能没有影响。
术后第2天活检部位超声征象便与术前检查无明显差异,但剖检与组织学切片显示损伤尚未修复。本试验试验犬靶器官损伤于术后8周仍未恢复,故8周内对同一部位进行连续活检无临床诊断意义。
参考文献
[1] Cuccovillo, A. and C.R. Lamb, Cellular features of sonographic target lesions of the liver and spleen in 21 dogs and a cat. Veterinary Radiology & Ultrasound, 2002. 43(3): p. 275-278.
[2] Kerwin, S.C., Hepatic aspiration and biopsy techniques. Veterinary Clinics of North America: Small Animal Practice, 1995. 25(2): p. 275-291.
[3] Gazelle, G.S., J.R. Haaga, and D.Y. Rowland, Effect of needle gauge, level of anticoagulation, and target organ on bleeding associated with aspiration biopsy. Work in progress. Radiology, 1992. 183(2): p. 509-513.
[4] L Thanos, A Zormpala, G Papaioannou, et al., Safety and efficacy of percutaneous CT-guided liver biopsy using an 18-gauge automated needle. European journal of internal medicine, 2005. 16(8): p. 571-574.
[5] Hager, D.A., T.G. Nyland, and P. Fisher, Ultrasound-guided biopsy of the canine liver, kidney, and prostate. Veterinary Radiology, 1985. 26(3): p. 82-88.
[6] Raskin, R.E. and D. Meyer, Canine and feline cytology: A color atlas and interpretation guide. 2009: Elsevier Health Sciences.
[7] Zachary, J.F. and M.D. McGavin, Pathologic basis of veterinary disease. 2013: Elsevier Health Sciences.
[8] AT Watson, D Penninck, JS Knoll, et al., Safety and correlation of test results of combined ultrasound-guided fine-needle aspiration and needle core biopsy of the canine spleen. Veterinary Radiology & Ultrasound, 2011. 52(3): p. 317-322.
[9] NI Christensen, PJ Canfield, PA Martin, et al., Cytopathological and histopathological diagnosis of canine splenic disorders. Australian veterinary journal, 2009. 87(5): p. 175-181.
[10] Falstrom, J.K., et al., Use of fibrin sealant to reduce bleeding after needle liver biopsy in an anticoagulated canine model: work in progress. Journal of vascular and interventional radiology, 1999. 10(4): p. 457-462.
[11] Penninck, D. and M.-A. d'Anjou, Atlas of small animal ultrasonography. 2013: John Wiley & Sons.